ヘパラン硫酸

ヘパラン硫酸(ヘパランりゅうさん、英: heparan sulfate、略称: HS)は、全ての動物組織に存在する直線形構造の多糖である[1]。細胞表面近傍で2つから3つのHS鎖が付加されたプロテオグリカン(ヘパラン硫酸プロテオグリカン)として、または細胞外マトリックスタンパク質として存在する[2][3]。HSはこうした形態をとっているときにWntなどのさまざまなタンパク質リガンドを結合し[4][5]、発生過程、血管新生、血液凝固、グランザイムBの剥離活性の無効化[6]、腫瘍の転移など広範囲の生物学的過程を調節する。HSはRSウイルスなどいくつかのウイルスの細胞受容体となることも示されている[7]。SARS-CoV-2の感染時、特にウイルスがACE2に接着する際にHSが関与していることを示唆する研究もある[8]。
プロテオグリカン[編集]
細胞膜上の主要なヘパラン硫酸プロテオグリカン(HSPG)は、膜貫通タンパク質シンデカンとGPIアンカータンパク質グリピカンである[9][10]。その他マイナーな膜上HSPGとしては、TGFBR3や[11]、ケラチノサイトと活性化された単球上に存在するCD44のv3アイソフォーム[12]などがある。
細胞外マトリックス、特に基底膜やフラクトンでは、マルチドメインタンパク質パーレカン、アグリン、XVIII型コラーゲンコアタンパク質が主要なHS含有タンパク質である。
構造およびヘパリンとの差異[編集]
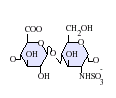
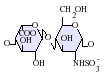
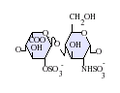
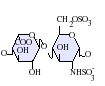
ヘパラン硫酸はグリコサミノグリカン(GAG)ファミリーの炭水化物であり、その構造はヘパリンと密接に関連している。抗凝固薬として広く知られているヘパリンはHSの高度に硫酸化された形態であり、HSとは異なりマスト細胞の分泌顆粒に主に存在する[13]。どちらもさまざまな硫酸化が施された二糖単位の反復構造から構成される。ヘパラン硫酸やヘパリンでみられる主要な二糖単位を下に示す。
ヘパラン硫酸で最も一般的な二糖単位はグルクロン酸(GlcA)とN-アセチルグルコサミン(GlcNAc)が結合したものであり、全二糖単位の約50%を占める。一方ヘパリンでは、IdoA(2S)-GlcNS(6S)がウシ肺由来ヘパリンの86%、ブタ腸管粘膜由来ヘパリンの75%を占める。問題が生じるのは、「ヘパリン様」構造と「HS様」構造の双方を持つハイブリッド型GAGを定義する際である。N-硫酸基の含有量がN-アセチル基の含有量を大きく上回り、O-硫酸基の濃度がN-硫酸基の濃度を上回る場合にのみ、ヘパリンとすることが提案されている[14]。
下に示されていな稀な二糖としては、3-O-硫酸化修飾がなされたグルコサミン(GlcNS(3S,6S))や修飾されていないアミン基を持つグルコサミン(GlcNH3+)を含むものがある。生理的条件下では、エステルやアミドで連結された硫酸基は脱プロトン化しており、正に荷電した対イオンを誘引して塩を形成している。細胞表面では、HSはこうした形態で存在していると考えられている。
-
GlcA-GlcNAc
-
GlcA-GlcNS
-
IdoA-GlcNS
-
IdoA(2S)-GlcNS
-
IdoA-GlcNS(6S)
-
IdoA(2S)-GlcNS(6S)
略号[編集]
- GlcA = β-D-グルクロン酸
- IdoA = α-L-イズロン酸
- IdoA(2S) = 2-O-sulfo-α-L-iduronic acid
- GlcNAc = 2-deoxy-2-acetamido-α-D-glucopyranosyl
- GlcNS = 2-deoxy-2-sulfamido-α-D-glucopyranosyl
- GlcNS(6S) = 2-deoxy-2-sulfamido-α-D-glucopyranosyl-6-O-sulfate
生合成[編集]
多くの細胞種でさまざまな一次構造を持つヘパラン硫酸鎖が産生される。HS鎖の合成にはかなり多様な方法が存在し、「ヘパラノーム」("heparanome")と総称される構造的多様性が生み出される。ヘパラノームは特定の細胞、組織または個体で産生される一次構造の総体である[15]。一次配列に関わらず、HSの形成にはさまざまな生合成酵素が不可欠である。こうした酵素にはグリコシルトランスフェラーゼ、スルホトランスフェラーゼ、エピメラーゼが含まれる。また、同じ酵素がヘパリンの合成にも関わっている。
1980年代にJeffrey Eskoは、ヘパラン硫酸の構築に変化が生じた動物細胞変異体を初めて単離し、特性解析を行った[16]。現在ではヘパラン硫酸合成に関わる酵素は精製や分子クローニングがなされており、発現パターンの研究が行われている。この研究やHS/ヘパリン生合成の初期の基礎的研究はマウス肥満細胞腫無細胞系を用いて行われ、酵素の反応順序や特異性など多くのことが明らかとなった[17]。
糖鎖形成の開始[編集]

HSの合成は、キシロシルトランスフェラーゼ(XT)によってキシロース(Xyl)がUDP-キシロースからコアタンパク質内の特定のセリン残基へ転移されることで開始される。ガラクトシルトランスフェラーゼI、II(GalTI、GalTII)によって2つのガラクトース(Gal)、そしてグルクロノシルトランスフェラーゼI(GlcATI)によってグルクロン酸(GlcA)が付加されることで、コアタンパク質のセリン残基にO-結合した四糖プライマー(βGlcA-(1→3)-βGal-(1→3)-βGal-(1→4)-βXyl-O-Ser)が完成する。
コアタンパク質へのキシロースの付加は小胞体で行われ、残りの連結の組み立てはゴルジ体で行われると考えられている。
HS/ヘパリン、コンドロイチン硫酸(CS)、デルマタン硫酸(DS)の生合成経路はこの共通した四糖構造の形成後に分岐する。次に作用する酵素がGlcNAcTIであるかGalNAcTIであるかによって、HS/ヘパリンとCS/DSのどちらが合成されるかが決定される。
糖鎖の伸長[編集]
最初のN-アセチルグルコサミン(GlcNAc)残基が付加された後、四糖リンカーの伸長はGlcAとGlcNAcの段階的付加によって継続される。これらの糖はUDP-糖ヌクレオチドから転移される。この反応は外骨腫(EXT)遺伝子ファミリーのメンバーの酵素によって行われる。
EXT1、EXT2、EXT3遺伝子座の変異によって細胞はHSを産生することができなくなり、このことが遺伝性多発性外骨腫(MHE)の発症の原因となる。骨軟骨腫または外骨腫と呼ばれる、軟骨帽に覆われた腫瘍によってMHEは特徴づけられ、こうした腫瘍は幼児期から思春期にかけて主に長骨に発生する[18]。
糖鎖の修飾[編集]
HS鎖が重合するにつれて、4種類のスルホトランスフェラーゼと1種類のエピメラーゼによって一連の修飾反応が行われる。スルホトランスフェラーゼの活性には、硫酸基の供与体となる3'-ホスホアデノシン-5'-ホスホ硫酸(PAPS)の存在が重要である[19][20]。
N-脱アセチル化/N-硫酸化[編集]
最初に行われるポリマーへの修飾は、GlcNAc残基に対するN-脱アセチル化/N-硫酸化によるGlcNSへの変換である。この修飾はその後の全ての修飾反応の必要条件であり、4つのGlcNAc N-デアセチラーゼ/N-スルホトランスフェラーゼ(NDST)ファミリーのメンバーによって行われる。初期の研究では、修飾酵素は形成中のポリマー内のいかなるN-アセチル化残基に対しても認識し、作用できることが示されている[21]。そのためGlcNAc残基の修飾は鎖中でランダムに生じることが予想されるが、実際にはN-硫酸化残基は主に集まって存在しており、未修飾GlcNAcのN-アセチル化領域によって隔てられて位置している。
NDSTには4種類のアイソフォーム(NDST1–4)が存在する。NDSTの全てのアイソフォームがN-デアセチラーゼ活性とN-スルホトランスフェラーゼ活性の双方を有するが、その酵素活性はそれぞれ大きく異なる[22]。
GlcNH2の生成[編集]
N-デアセチラーゼとN-スルホトランスフェラーゼは同じ酵素によって行われるため、通常、N-硫酸化はN-脱アセチル化と密接に共役している。一方で、2つの活性の脱共役によって形成されたと思われるGlcNH2残基もヘパリンや一部のHSに存在している[23]。
エピマー化と2-O-硫酸化[編集]
エピマー化はGlcA C5エピメラーゼまたはヘパロサン-N-硫酸-グルクロン酸 5-エピメラーゼ(EC 5.1.3.17)と呼ばれる1つの酵素によって触媒される。この酵素はGlcAをイズロン酸(IdoA)へエピマー化する。基質認識には、標的となるGlcAの非還元末端側に結合したGlcN残基がN-硫酸化されていることが必要である。その結果形成されたIdoA残基はウロノシル-2-O-スルホトランスフェラーゼ(2OST)によって硫酸化される。
6-O-硫酸化[編集]
硫酸化または非硫酸化IdoAに隣接したGlcNS(6S)の形成を担うグルコサミニル-6-O-スルホトランスフェラーゼ(6OST)が3種類同定されている。成熟型HS鎖にはGlcNAc(6S)も存在する。
3-O-硫酸化[編集]
現在では、哺乳類には7種類(ゼブラフィッシュでは8種類)のグルコサミニル-3-O-スルホトランスフェラーゼ(3OST、HS3ST)が存在することが知られている[24][25]。3OSTは、GlcA-GlcNS(3S±6S)(HS3ST1、HS3ST5による修飾)、IdoA(2S)-GlcNH2(3S±6S)(HS3ST3A1、HS3ST3B1、HS3ST5、HS3ST6)、GlcA/IdoA(2S)-GlcNS(3S)(HS3ST2 、HS3ST4)など、いつくかの3-O-硫酸化二糖を形成する[26][27]。他の全てのヘパラン硫酸スルホトランスフェラーゼと同様、3OSTはPAPSを硫酸基供与体として利用する。3OSTはヘパラン硫酸修飾酵素の中で最大のファミリーを構成しているものの、3OSTによって行われる修飾は最も稀であり、特定のグルコサミン残基のC3-OHが硫酸化される[28]。
3OSTは、アンチトロンビンIII結合部位を形成するもの(HS3ST1、HS3ST5)、そして単純ヘルペスウイルス1型糖タンパク質D(HSV-1 gD)結合部位を形成するもの(HS3ST2、HS3ST3A1、HS3ST3B1、HS3ST4、HS3ST5、HS3ST6)という2つの機能的サブカテゴリに分類される[26][27][29][30][31][32][33][34][35][36][37]。3OSTはHS修飾酵素の中で最大のファミリーであること、そしてこれらの作用が律速段階であり、基質特異性があり、稀な修飾を形成することから、3OSTによって修飾されたHSは生物学的過程において重要な調節機能を果たしていることが予想されている[30][32]。3-O-硫酸化はWntのグリピカンへの結合を強化することが示されており、がんにおけるWntの調節に関与している可能性がある[5][10]。
リガンド結合[編集]
ヘパラン硫酸は多数の細胞外タンパク質に結合する。これらは類縁多糖であるヘパリンを用いたアフィニティクロマトグラフィーによって単離されたため、まとめて「ヘパリンインタラクトーム」("heparin interactome")または「ヘパリン結合タンパク質」("heparin-binding proteins")と呼ばれることも多いが、「ヘパラン硫酸インタラクトーム」("heparan sulfate interactome")という語の方がより正確である。ヘパラン硫酸結合タンパク質の機能は、細胞外マトリックスの構成要素、酵素、血液凝固因子、成長因子、サイトカイン、ケモカイン、モルフォゲンなどさまざまである[38]。
ファージディスプレイによって、ヘパラン硫酸に対して高い親和性で結合するHS20ヒトモノクローナル抗体が単離されている[39]。この抗体はヘパラン硫酸に結合するが、コンドロイチン硫酸には結合しない[5]。HS20のヘパラン硫酸への結合には、C2位とC6位の双方の硫酸化が必要である。HS20はWntのヘパラン硫酸への結合を遮断し[5]、また病原性JCポリオーマウイルスの侵入感染も阻害する[40]。
インターフェロンγ[編集]
インターフェロンγの細胞表面受容体結合領域は、C末端付近に位置するHS結合領域と重複している。HSの結合は受容体結合部位を遮断し、そのためHSとの複合体は不活性である[41]。
Wnt[編集]
グリピカン3(GPC3)はWntとFrizzledの双方と相互作用し、下流のシグナル伝達を開始する複合体を形成する[4][10]。WntはGPC3のIdoA2SとGlcNS6Sを含むヘパラン硫酸モチーフを認識し、GlcNS6S3Sへの3-O-硫酸化は結合を強化することが実験的に示されている[5]。
その他多くのタンパク質のHS結合特性の研究が行われている。
ヘパラン硫酸アナログ[編集]
ヘパラン硫酸アナログは、創傷部位などタンパク質分解環境でも安定であることを除いて、ヘパラン硫酸と同一の性質を示すと考えられている[42][43]。ヘパラン硫酸は慢性創傷部位ではヘパラナーゼによって分解され、こうしたヘパラン硫酸が存在しない部位でヘパラン硫酸アナログは結合する。そして既知のいかなるヘパラナーゼやグリカナーゼによっても分解されない。ヘパラン硫酸アナログの機能はヘパラン硫酸と同じであり、成長因子やサイトカインなどさまざまなタンパク質リガンドを保護する。それらを正しい場所に保持することで、組織はさまざまなタンパク質リガンドを増殖のために利用することができるようになる[44]。
出典[編集]
- ^ “Distribution of sulfated glycosaminoglycans in the animal kingdom: widespread occurrence of heparin-like compounds in invertebrates”. Biochimica et Biophysica Acta (BBA) - General Subjects 1475 (3): 287–94. (July 2000). doi:10.1016/S0304-4165(00)00079-9. PMID 10913828.
- ^ “Molecular structure of Heparan Sulfate and interactions with growth factors and morphogens”. Proteoglycans: structure, biology and molecular interactions. New York, New York: Marcel Dekker Inc.. (2000). pp. 27–59
- ^ “Matrix proteoglycans: from molecular design to cellular function”. Annual Review of Biochemistry 67: 609–52. (1998). doi:10.1146/annurev.biochem.67.1.609. PMID 9759499.
- ^ a b “Inactivation of Wnt signaling by a human antibody that recognizes the heparan sulfate chains of glypican-3 for liver cancer therapy”. Hepatology 60 (2): 576–87. (August 2014). doi:10.1002/hep.26996. PMC 4083010. PMID 24492943.
- ^ a b c d e “Epitope mapping by a Wnt-blocking antibody: evidence of the Wnt binding domain in heparan sulfate”. Scientific Reports 6: 26245. (May 2016). Bibcode: 2016NatSR...626245G. doi:10.1038/srep26245. PMC 4869111. PMID 27185050.
- ^ “Extracellular matrix remodeling by human granzyme B via cleavage of vitronectin, fibronectin, and laminin”. The Journal of Biological Chemistry 280 (25): 23549–58. (June 2005). doi:10.1074/jbc.M412001200. PMID 15843372.
- ^ “Glycosaminoglycan sulfation requirements for respiratory syncytial virus infection”. Journal of Virology 74 (22): 10508–13. (November 2000). doi:10.1128/JVI.74.22.10508-10513.2000. PMC 110925. PMID 11044095.
- ^ “SARS-CoV-2 Infection Depends on Cellular Heparan Sulfate and ACE2”. The Journal of Cell 183 (4): 1043–1057.e15. (14 September 2020). doi:10.1016/j.cell.2020.09.033. PMC 7489987. PMID 32970989.
- ^ “Glypican-3: a new target for cancer immunotherapy”. European Journal of Cancer 47 (3): 333–8. (February 2011). doi:10.1016/j.ejca.2010.10.024. PMC 3031711. PMID 21112773.
- ^ a b c “Glypicans as Cancer Therapeutic Targets”. Trends in Cancer 4 (11): 741–754. (November 2018). doi:10.1016/j.trecan.2018.09.004. PMC 6209326. PMID 30352677.
- ^ “Binding of two growth factor families to separate domains of the proteoglycan betaglycan”. The Journal of Biological Chemistry 267 (9): 5927–30. (March 1992). doi:10.1016/S0021-9258(18)42643-9. PMID 1556106.
- ^ “Proteoglycan forms of the lymphocyte homing receptor CD44 are alternatively spliced variants containing the v3 exon”. The Journal of Cell Biology 128 (4): 673–85. (February 1995). doi:10.1083/jcb.128.4.673. PMC 2199896. PMID 7532175.
- ^ “Heparan Sulfate Proteoglycans”. Cold Spring Harb Perspect Biol 3 (7): a004952. (July 2011). doi:10.1101/cshperspect.a004952. PMC 3119907. PMID 21690215.
- ^ “Molecular distinctions between heparan sulphate and heparin. Analysis of sulphation patterns indicates that heparan sulphate and heparin are separate families of N-sulphated polysaccharides”. The Biochemical Journal 230 (3): 665–74. (September 1985). doi:10.1042/bj2300665. PMC 1152670. PMID 2933029.
- ^ “Heparan sulfate: decoding a dynamic multifunctional cell regulator”. Trends in Cell Biology 11 (2): 75–82. (February 2001). doi:10.1016/s0962-8924(00)01897-3. PMID 11166215.
- ^ “Animal cell mutants defective in glycosaminoglycan biosynthesis”. Proceedings of the National Academy of Sciences of the United States of America 82 (10): 3197–201. (May 1985). Bibcode: 1985PNAS...82.3197E. doi:10.1073/pnas.82.10.3197. PMC 397742. PMID 3858816.
- ^ “Regulated diversity of heparan sulfate”. The Journal of Biological Chemistry 273 (39): 24979–82. (September 1998). doi:10.1074/jbc.273.39.24979. PMID 9737951.
- ^ “Hereditary Multiple Exostoses: a review of clinical appearance and metabolic pattern”. Clinical Cases in Mineral and Bone Metabolism 13 (2): 110–118. (2016). doi:10.11138/ccmbm/2016.13.2.110. PMC 5119707. PMID 27920806.
- ^ “Biosynthesis of heparin. 3. Formation of a sulfated glycosaminoglycan with a microsomal preparation from mast cell tumors”. The Journal of Biological Chemistry 242 (21): 5146–52. (November 1967). doi:10.1016/S0021-9258(18)99487-1. PMID 4228675.
- ^ “Heparin/heparan sulfate biosynthesis: processive formation of N-sulfated domains”. The Journal of Biological Chemistry 283 (29): 20008–14. (July 2008). doi:10.1074/jbc.M801652200. PMID 18487608.
- ^ “Biosynthesis of heparin. Studies on the microsomal sulfation process”. The Journal of Biological Chemistry 250 (15): 6065–71. (August 1975). doi:10.1016/S0021-9258(19)41159-9. PMID 807579.
- ^ “Multiple isozymes of heparan sulfate/heparin GlcNAc N-deacetylase/GlcN N-sulfotransferase. Structure and activity of the fourth member, NDST4”. The Journal of Biological Chemistry 276 (8): 5876–82. (February 2001). doi:10.1074/jbc.M009606200. PMID 11087757.
- ^ “Structural differences and the presence of unsubstituted amino groups in heparan sulphates from different tissues and species”. The Biochemical Journal 322 ( Pt 2) (Pt 2): 499–506. (March 1997). doi:10.1042/bj3220499. PMC 1218218. PMID 9065769.
- ^ “Combinatorial expression patterns of heparan sulfate sulfotransferases in zebrafish: III. 2-O-sulfotransferase and C5-epimerases”. Developmental Dynamics 236 (2): 581–6. (February 2007). doi:10.1002/dvdy.21051. PMID 17195182.
- ^ “Combinatorial expression patterns of heparan sulfate sulfotransferases in zebrafish: III. 2-O-sulfotransferase and C5-epimerases”. Developmental Dynamics 236 (2): 581–6. (February 2007). doi:10.1002/dvdy.21051. PMID 17195182.
- ^ a b “A novel role for 3-O-sulfated heparan sulfate in herpes simplex virus 1 entry”. Cell 99 (1): 13–22. (October 1999). doi:10.1016/s0092-8674(00)80058-6. PMID 10520990.
- ^ a b “Heparan sulfate 3-O-sulfotransferase isoform 5 generates both an antithrombin-binding site and an entry receptor for herpes simplex virus, type 1”. The Journal of Biological Chemistry 277 (40): 37912–9. (October 2002). doi:10.1074/jbc.m204209200. PMID 12138164.
- ^ “Mice deficient in heparan sulfate 3-O-sulfotransferase-1: normal hemostasis with unexpected perinatal phenotypes”. Glycoconjugate Journal 19 (4–5): 355–61. (2003). doi:10.1023/a:1025377206600. PMID 12975616.
- ^ “Characterization of heparan sulphate 3-O-sulphotransferase isoform 6 and its role in assisting the entry of herpes simplex virus type 1”. The Biochemical Journal 385 (Pt 2): 451–9. (January 2005). doi:10.1042/bj20040908. PMC 1134716. PMID 15303968.
- ^ a b “The principal neuronal gD-type 3-O-sulfotransferases and their products in central and peripheral nervous system tissues”. Matrix Biology 26 (6): 442–55. (July 2007). doi:10.1016/j.matbio.2007.03.002. PMC 1993827. PMID 17482450.
- ^ “Purification of heparan sulfate D-glucosaminyl 3-O-sulfotransferase”. The Journal of Biological Chemistry 271 (43): 27072–82. (October 1996). doi:10.1074/jbc.271.43.27072. PMID 8900198.
- ^ a b “Molecular cloning and expression of mouse and human cDNAs encoding heparan sulfate D-glucosaminyl 3-O-sulfotransferase”. The Journal of Biological Chemistry 272 (44): 28008–19. (October 1997). doi:10.1074/jbc.272.44.28008. PMID 9346953.
- ^ “Multiple isoforms of heparan sulfate D-glucosaminyl 3-O-sulfotransferase. Isolation, characterization, and expression of human cdnas and identification of distinct genomic loci”. The Journal of Biological Chemistry 274 (8): 5170–84. (February 1999). doi:10.1074/jbc.274.8.5170. PMID 9988767.
- ^ “Biosynthesis of 3-O-sulfated heparan sulfate: unique substrate specificity of heparan sulfate 3-O-sulfotransferase isoform 5”. Glycobiology 13 (11): 785–94. (November 2003). doi:10.1093/glycob/cwg101. PMID 12907690.
- ^ “The biosynthesis of anticoagulant heparan sulfate by the heparan sulfate 3-O-sulfotransferase isoform 5”. Biochimica et Biophysica Acta (BBA) - General Subjects 1671 (1–3): 34–43. (March 2004). doi:10.1016/j.bbagen.2003.12.010. PMID 15026143.
- ^ “Characterization of the structure of antithrombin-binding heparan sulfate generated by heparan sulfate 3-O-sulfotransferase 5”. Biochimica et Biophysica Acta (BBA) - General Subjects 1725 (2): 190–200. (September 2005). doi:10.1016/j.bbagen.2005.06.012. PMID 16099108.
- ^ “Synthesis of anticoagulantly active heparan sulfate proteoglycans by glomerular epithelial cells involves multiple 3-O-sulfotransferase isoforms and a limiting precursor pool”. The Journal of Biological Chemistry 280 (45): 38059–70. (November 2005). doi:10.1074/jbc.m507997200. PMID 16107334.
- ^ “The heparanome and regulation of cell function: structures, functions and challenges”. Frontiers in Bioscience 13 (13): 4309–38. (May 2008). doi:10.2741/3007. PMID 18508513.
- ^ “Isolation of Antibodies to Heparan Sulfate on Glypicans by Phage Display”. Current Protocols in Protein Science 94 (1): e66. (November 2018). doi:10.1002/cpps.66. PMC 6205898. PMID 30091851.
- ^ “Infectious Entry and Neutralization of Pathogenic JC Polyomaviruses”. Cell Reports 21 (5): 1169–1179. (October 2017). doi:10.1016/j.celrep.2017.10.027. PMC 5687836. PMID 29091757.
- ^ “The heparan sulfate binding sequence of interferon-gamma increased the on rate of the interferon-gamma-interferon-gamma receptor complex formation”. The Journal of Biological Chemistry 273 (18): 10919–25. (May 1998). doi:10.1074/jbc.273.18.10919. PMID 9556569.
- ^ “Stimulated neovascularization, inflammation resolution and collagen maturation in healing rat cutaneous wounds by a heparan sulfate glycosaminoglycan mimetic, OTR4120”. Wound Repair and Regeneration 17 (6): 840–52. (2009). doi:10.1111/j.1524-475X.2009.00548.x. PMID 19903305.
- ^ “Heparan sulfate glycosaminoglycan mimetic improves pressure ulcer healing in a rat model of cutaneous ischemia-reperfusion injury”. Wound Repair and Regeneration 19 (4): 505–14. (2011). doi:10.1111/j.1524-475X.2011.00704.x. PMID 21649786.
- ^ Blanquaert, F.; Saffar, J. L.; Colombier, M. L.; Carpentier, G.; Barritault, D.; Caruelle, J. P. (1995-12). “Heparan-like molecules induce the repair of skull defects”. Bone 17 (6): 499–506. doi:10.1016/8756-3282(95)00402-5. ISSN 8756-3282. PMID 8835301.