アノマー効果

有機化学において、アノマー効果(アノマーこうか、英: anomeric effect)あるいはエドワード=レミュー効果(Edward-Lemieux effect)は、立体電子効果の一つである。シクロヘキサン環内のヘテロ原子に隣接するヘテロ原子性置換基が、立体的考察から予測される障害の少ないエクアトリアル配置ではなくアキシアル配置を好む傾向を説明する[1]。1955年に、J・T・エドワードによってピラノース環において初めて観測された。
「アノマー効果」という用語は1958年に導入された[2]。この名称は、ピラノースのC-1位炭素を指定する用語である「アノマー」炭素から来ている。アノマー炭素における立体配置のみが異なる異性体は「アノマー」と呼ばれる。グルコピラノースのアノマーはジアステレオマーである。β-アノマーはエクアトリアル位にOH基を持ち、α-アノマーはアキシアル位にOH基を持つ。
アノマー効果は、一般式C-Y-C-X(Yは1つ以上の非共有電子対を持つヘテロ原子、Xは電気陰性原子あるいは基)を持つシクロヘキシルあるいは鎖状系にも一般化することができる[3]。アノマー効果の度合いは糖の場合はおよそ1~2 kcal/molと見積られるが、全ての分子で異なる。

上図の場合、シクロヘキサン環(上)上のメトキシ基はエクアトリアル位を好む。しかしながら、テトラヒドロピラン環(下)では、メトキシ基はアキシアル位を好む。これは、シクロヘキサン環ではYが炭素(ヘテロ原子ではない)であるためで、この場合はアノマー効果は観測されず、立体効果が支配的である。テトラヒドロピラン環では、Yがヘテロ原子の酸素であるため、アノマー効果が置換基の配向に寄与し、安定化する。どちらの場合もX = OMeである。
アノマー効果はYが酸素の時に最もよく観測されるが、環内に窒素、硫黄、リンといった非共有電子対を持つその他のヘテロ原子がある場合も見られる[4]。アノマー効果が安定化に寄与する具体的な方法は論点となっており、複数の仮説がこれまでに提唱されている。
物理的学的説明および論争[編集]
アノマー効果の物理学的理由は完全には分かっていない。(部分的に対立する)複数の説明が提案されており、この話題はまだ決着がついていない[5]。
超共役[編集]
環状分子[編集]
糖の環内のヘテロ原子上の非共有電子対とアキシアル(環外の)C-X結合のσ* 軌道との間の安定化相互作用(超共役)が存在するという説明が広く受け入れられている。この場合、電子供与性の非共有電子対がσ* 軌道とアンチペリプラナー(180°)となった時、系の全エネルギーが低下し、より安定となる[6]。

一部の著者らは、分子中の原子の量子論からの結果に基づいて、この超共役モデルの妥当性に対して疑問を投げ掛けている[7]。アノマー効果に関するほとんどの研究が理論的なものであるが、n–σ*(超共役)仮説はこの仮説によって提唱されるアセタールにおける電子密度の再分布が、アセタールの既知の実験化学、特に単糖の化学と合致しないことに基づいて広く批判を受けてもいる[8][9]。
非環状分子[編集]
超共役はヘテロ原子を含む非環状分子においても見られる。分子が非共有電子対を有する原子を持ち、隣接する原子がσ* へ電子を受容することができる時、分子を安定化する超共役が起こる。この軌道の重なりが起こるためには、ほとんどのヘテロ原子でtrans-trans配座が好まれるが、ジメトキシメタンで起こる安定化では、gauche, gauche配座がtrans,trans配座よりも約3~5 kcal/molエネルギーが低い(より安定である)。ジメトキシエタンの場合は2つの回転可能な結合があるため、安定化エネルギーは糖の場合よりも約2倍大きい[10]。

双極子の最小化[編集]
アノマー効果について受け入れられているもう一つの説明は、エクアトリアル配置は2つのヘテロ原子が部分的に並んでいるため、双極子間の反発が起こる、というものである。対照的に、アキシアル配置ではこれらの双極子はおおよそ逆向きであり、より安定な状態となる。

超共役と双極子の最小化はどちらも、エステルが (E)-配座よりも (Z)-配座を好むことに寄与している。(Z) 配座では、α酸素の非共有電子対が隣接するσ* C-O軌道に電子を供与することができる。加えて、双極子は(Z)-配座で最小化され、(E)-配座で最大化される[6]。

n-n反発およびC-H水素結合[編集]
2-メトキシピランのアノマー中心における酸素の非共有電子対を示した場合、β-アノマーでは常に少なくとも一つの非共有電子対のペアがエクリプス型となり、このn-n反発によりエネルギーは不安定化する。一方、α-アノマーはn-n反発のない配座を取っている。このβ-アノマーに存在するエネルギー的に不利なn-n反発と、アキシアルH-5とアキシアルα-アノマー置換基上の非共有電子対との間のエネルギー的に有利なC-H水素結合は、アノマー間のエネルギー差の主要因であることが示唆されている[8][9]。
アノマー効果の影響[編集]
アノマー効果は、分子のこの種の安定化に対する一般的な説明であるが、安定化の種類および度合いは調べる置換基や用いられる溶媒によって影響を受ける。
置換基効果[編集]
シクロヘキサンあるいはテトラヒドロピラン環(Y = 酸素)上の置換基によって、観測されるアノマー効果には差異がある。XがOHの時は、一般的なアノマー効果が見られる。XがCNの時も同様の結果が得られる(シクロヘキサン環ではエクアトリアル位を好むのに対して、テトラヒドロピラン環ではアキシアル位を好む)。XがFの時は、どちらの環においてもアノマー効果が観測される。しかしながら、XがNH2の時は、アノマー効果は観測されず、どちらの系においても置換基はエクアトリアル位を好む。これは立体的効果と逆アノマー効果と呼ばれる効果が原因である[3]。
溶媒効果[編集]
超共役理論に対する一般的な反論の一つは、置換テトラヒドロピラン分子が極性溶媒中に置かれた時になぜアノマー効果が観測されないかを説明できないという点である。しかしながら、超共役は系の溶媒に依存することが明らかにされている。上述したどちらの置換系も気相(すなわち無溶媒)と水溶液(すなわち極性溶媒)で試験されている。XがFの時、どちらの媒質においてもアノマー効果が観測される。これは超共役に起因する。XがOHあるいはCNの時は、気相においてアノマー効果が見られる。しかしながら水溶液中では、どちらの置換基もエクアトリアル位を好む。これはアキシアル位の置換基が極性溶媒とより静電反発を起こるためである。XがNH2の時は、アノマー効果は観測されず、置換基は常にエクアトリアル位を好む[11]。
アノマー効果を乗り越える[編集]
アノマー効果は分子の安定化を引き起こすことができるが、その安定化には大きさがあり、この値はその他のより不安定化に寄与する効果によって乗り越えられる。
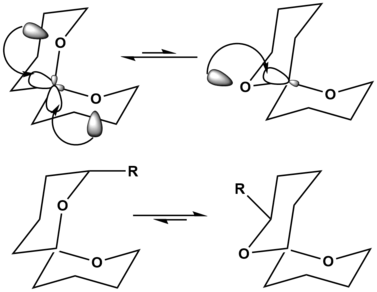
スピロアセタールの例では、上図の左上の配向は2つの超共役アノマー効果による安定化を示しており、分子の配向は大きく安定化されている。右上の配向は超共役アノマー効果が1つであり、相対的に不安定である。しかしながら、スピロアセタール骨格に置換基が追加されると、安定構造は変化し得る。左下に示すように、大きな置換基がスピロアセタール骨格に追加されると、この大きな置換基Rがアキシアル位にあることでひずみが生じ、分子は著しく不安定化される[12]。
エキソアノマー効果[編集]
アノマー効果の拡張であるエキソアノマー効果 (exo anomeric effect) では、アンチペリプラナー配座が立体障害が小さいにもかかわらず、置換基がゴーシュ配座を好む。

2-メトキシテトラヒドロピランが一つの例である。アノマー効果から予測されるように、メトキシ置換基はアキシアル配座を好む。しかしながら、メトキシ置換基と環との間のC-O結合の回転によってアキシアル配座は1つだけではない。逆アノマー効果の原則を適用すると、ゴーシュ配座が有利であり、上図の上段左の配座が最安定であることが示唆れる。この翌は実験事実によって支持れている。そのうえ、ゴーシュ配座が有利となることは、エクアトリアル配座でも見られる[13]。
逆アノマー効果[編集]
逆アノマー効果とは、酸素といった電気陰性原子を含む環における正に荷電した窒素置換基がエクアトリアル配座を好むことを意味する。部分的に正に荷電した炭素を含む置換基では同じ効果を示さない[14]。これが本当の現象であるかについては論争がある。窒素を含む置換基は非常に大きいため、もし逆アノマー効果が存在したとしても、通常の立体障害による効果と逆アノマー効果を区別することは困難である、と指摘されている[15]。例えば、下図で示されている分子において、ピリジニウム置換基は立体要因で予測されるようにエクアトリアル位を強く好むが、予測されるよりもこの配座がより有利になることが実際示されていることから、逆アノマー効果が寄与していることが示唆されている。

合成への応用[編集]
アノマー効果は合成的に考慮される。糖において発見されたため、糖や炭水化物の化学において合成的に用いられることが多い。例えば、ケーニッヒ=クノールグリコシル化は、α-ORあるいはβ-ORを高いジアステレオ選択性(アノマー効果によって影響される)で導入する。ソホロリピドラクトン、(+)-Lepicidin A、(−)-Lithospermosideはアノマー効果を乗り越えたケーニッヒ=クノールグリコシル化によって合成された少数の例である[16]。

脚注[編集]
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). オンライン版: (1996) "Anomeric Effect".
- ^ Juaristi, E.; Cuevas, G. (1992). “Recent studies of the anomeric effect”. Tetrahedron 48 (24): 5019–5087. doi:10.1016/S0040-4020(01)90118-8.
- ^ a b Bauerfeldt, Glauco F.; Cardozo, Thiago M.; Pereira, Márcio S.; da Silva, Clarissa O. (1 January 2013). “The anomeric effect: the dominance of exchange effects in closed-shell systems”. Organic & Biomolecular Chemistry 11 (2): 299. doi:10.1039/c2ob26818c.
- ^ Kirby, Anthony J. (1983). The anomeric effect and related stereoelectronic effects at oxygen ; with 24 tables. Berlin [u.a.]: Springer. ISBN 0-387-11684-2
- ^ Josh (2011年8月15日). “Anomeric argument”. Chemistry World Blog. 2014年2月14日閲覧。
- ^ a b Cuevas, Eusebio Juaristi, Gabriel (1995). The anomeric effect. Boca Raton: CRC Press. ISBN 0-8493-8941-0
- ^ Vila, A.; Mosquera, R. A. (2007). “Atoms in molecules interpretation of the anomeric effect in the O—C—O unit”. J. Comp. Chem. 28 (9): 1516–1530. doi:10.1002/jcc.20585. PMID 17330885.
- ^ a b Box, V. G. S. (1990). “The role of lone pair interactions in the chemistry of the monosaccharides. The anomeric effect”. Heterocycles 31 (6): 1157–1181. doi:10.3987/REV-90-414.
- ^ a b Box, V. G. S. (1991). “The role of lone pair interactions in the chemistry of the monosaccharides. Stereo-electronic effects in unsaturated monosaccharides”. Heterocycles 32 (4): 795–807. doi:10.3987/REV-91-425.
- ^ Sundberg, Francis A. Carey ; Richard J. (2007). Advanced Organic Chemistry : Part A: Structure and Mechanisms (5., ed.). Berlin: Springer US. ISBN 978-0-387-68346-1
- ^ Freitas, Matheus P. (1 January 2013). “The anomeric effect on the basis of natural bond orbital analysis”. Organic & Biomolecular Chemistry 11 (17): 2885. doi:10.1039/c3ob40187a.
- ^ Perron, Francoise; Albizati, Kim F. (1 November 1989). “Chemistry of spiroketals”. Chemical Reviews 89 (7): 1617–1661. doi:10.1021/cr00097a015.
- ^ Szarek, Walter A. (1979). Anomeric Effect: Origins and Consequences. Washington: American Chemical Society. ISBN 0-8412-0470-5
- ^ Kirby, A.J. (1983). The Anomeric Effect and Related Stereoelectronic Effects at Oxygen. New York: Springer-Verlag. ISBN 0-387-11684-2
- ^ Thatcher, Gregory R. J. (1993). The Anomeric Effect and Associated Stereoelectronic Effects. Washington: American Chemical Society. ISBN 0-8412-2729-2
- ^ Kürti, László; Czakó, Barbara (2007). Strategic applications of named reactions in organic synthesis : background and detailed mechanisms ; 250 named reactions (Pbk. ed., [Nachdr.]. ed.). Amsterdam [u.a.]: Elsevier Academic Press. ISBN 978-0-12-429785-2
