ホスファチジン酸
ホスファチジン酸(ホスファチジンさん、英: phosphatidic acid、略称: PA)は、細胞シグナル伝達と脂質依存性イオンチャネルの直接的活性化に重要なアニオン性リン脂質である。ホスファチジン酸の加水分解によって、グリセロールとリン酸が1分子ずつ、そして脂肪酸が2分子生じる。ホスファチジン酸は脂質二重層中のリン脂質のうち、約0.25%を占める[1]。
構造[編集]

ホスファチジン酸はグリセロール骨格を持ち、一般的にC1位には飽和脂肪酸、C2位に不飽和脂肪酸、C3位にリン酸基が結合している[2][3]。
形成と分解[編集]
ホスファチジン酸はde novo合成に加え、3通りの方法で形成される。
- ホスホリパーゼD(PLD)による、ホスファチジルコリン(PC)のP-O結合の加水分解を介したPAとコリンの産生[4]
- ジアシルグリセロールキナーゼ(DAGK)による、ジアシルグリセロール(DAG)のリン酸化
- リゾホスファチジン酸アシルトランスフェラーゼ(LPAAT)による、リゾホスファチジン酸(lysoPA)のアシル化。これが最も一般的な経路である[5]。
PAのde novo合成のグリセロール-3-リン酸経路は次のようなものである。
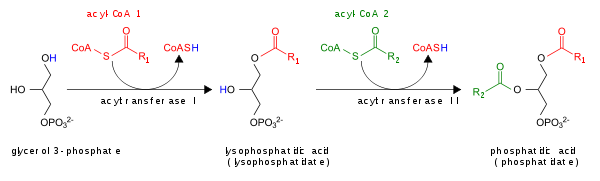
さらに、PAはホスファチジン酸ホスファターゼによってDAGへ、もしくはホスホリパーゼAによってリゾホスファチジン酸へ変換される。
細胞における役割[編集]
PAの細胞での役割は次のように分類される。
- 他の多くの脂質の生合成の前駆体となる。
- PAの物理的性質によって膜の曲率に影響を与える。
- シグナル伝達脂質として機能し、細胞質基質のタンパク質(スフィンゴシンキナーゼ1(SK1)[6]など)を適切な膜へリクルートする。
- ショウジョウバエのフォトトランスダクションに非常に重要な役割を果たす[7]。
- イオンチャネルを開閉する脂質リガンドとして機能する[8]。
最初の3つの役割は相互排他的なものではない。例えば、PAは膜の屈曲を促進したり、またネック部分の形成やくびり切りといったエネルギー的に不利な過程を担うタンパク質をリクルートしたりすることで、小胞形成に関与している可能性がある。
生合成における役割[編集]
PAは細胞の全てのアシルグリセロール脂質の(直接的または間接的な)形成の前駆体として、重要な細胞脂質である[9]。
哺乳類細胞と酵母細胞では、PAのde novo合成経路にはグリセロール-3-リン酸経路とジヒドロキシアセトンリン酸経路と呼ばれる2つの異なる経路が知られている。細菌には前者のみが存在し、この経路を遮断する変異は致死的となることからも、PAの重要性は示される。哺乳類細胞と酵母細胞では両経路は冗長的であり、いずれか一方の酵素の変異では致死的とはならない。しかしながらin vitroでは、さまざまなアシルトランスフェラーゼはPAに組み込まれるアシルCoAに関してそれぞれ異なる基質特異性を示す。また各アシルトランスフェラーゼごとに細胞内分布は小胞体、ミトコンドリア、ペルオキシソームなどさまざまであり、また活性化された脂肪酸の局所的濃度も異なる。このことは、哺乳類や酵母細胞に存在するさまざまなアシルトランスフェラーゼがさまざまなPAのプールの産生を担っている可能性を示唆している[9]。
ホスファチジン酸ホスファターゼによるPAからDAGへの変換は、ホスファチジルコリン(PC)、ホスファチジルエタノールアミン(PE)、ホスファチジルセリン(PS)産生の方向決定段階である。DAGはさらにCDP-DAGに変換され、ホスファチジルグリセロール(PG)、ホスファチジルイノシトール(PI)、ホスホイノシチド(PIP、PIP2、PIP3)の前駆体となる[9]。
ホスファチジン酸ホスファターゼの強力な活性によって、細胞内のPA濃度は極めて低く維持されている[10]。PAからDAGへの変換は非常に迅速であり、またDAGは非常に多くの脂質の前駆体であるため、DAG自体もすぐに他の膜脂質へ代謝される。PAは細胞内では正常な条件下では非常に低く維持されているが、脂質合成と細胞生存に必要不可欠である。
生物物理学的性質[編集]
PAはグリセロール骨格に極めて近接して荷電した小さな頭部をもつという点で、独特なリン脂質である。PAは小胞の分裂[11]と融合[12]の双方に関与しており、こうした役割はPAの生物物理学的性質と関係している可能性がある。
膜の出芽部位や融合部位では、膜の曲率は非常に高くなる。ゴルジ体からの輸送担体となる場合などの小胞出芽過程における大きなイベントは、膜のネック部分の形成とその後の狭窄である。この過程は脂質によって駆動されることが示唆されており、独特な分子的形状を有するDAGが中心的な役割を果たしていると考えられている。DAGは2つのアシル基を持つものの頭部が存在しないため、膜に大きな負の曲率が形成される[13]。
LPAAT活性を有するBARS50は、ゴルジ体からの出芽への関与が示唆されている[11]。このことは、lysoPAからPAへの変換が膜の曲率に影響を与える可能性を示唆している。LPAAT活性によってアシル鎖の数は2倍となるため、脂質の膜内の断面積は大きく増加するが、表面の頭部は変化しない。その結果、膜の負の曲率がより高くなる。31P-NMRを用いたPEの脂質二重層から非ラメラ相への転移温度の測定によって、膜の曲率に対するlysoPAとPAの影響の観察が行われており[14]、これらの脂質によってもたらされる曲率の変化はlysoPAとPAの構造だけでなく、その動的性質、すなわち頭部の水和や分子間・分子内相互作用にも依存していることが示されている。一例として、Ca2+は2分子のPAと相互作用し、中性だが曲率の高い複合体を形成する可能性がある。反発しあう頭部の電荷の中和、そして立体障害が存在しないことによって、アシル鎖間で強力な分子間相互作用が行われ、PAに富む微小ドメインが形成される。このようにin vitroでは、pH、温度、カチオン濃度の変化はPAやlysoPAによってもたらされる膜屈曲に強い影響を及ぼす[14]。lysoPA、PA、DAG間の相互変換、そしてpHやカチオン濃度の変化は膜の屈曲や不安定化を引き起こし、生物物理学的性質によって膜分裂に対して直接的に関与する。PAとlysoPAはin vitroでは膜の曲率に影響を与えることが示されているが、in vivoでの役割は不明確である。
lysoPA、PA、DAGの持つ膜の屈曲を促進する性質は、これらの膜へのタンパク質のリクルートにおける役割を排除するものではない。例えば、複雑なリポソームの融合に対するCa2+要求性はPLDによって低下するものの、アネキシンIは大きな影響を与えない。しかしながら、アネキシンIとPLDが共に存在する場合には、融合は大きく促進され、Ca2+要求性は1/1000以下、ほぼ生理的レベルにまで低下する[12]。
シグナル伝達における役割[編集]
PAは膜の大部分では低く維持されているが、それはシグナルを一過的に発火し、局所的に高濃度で伝達するためである[15]。一例として、TREK-1チャネルはPLDとの局所的な結合とPAの産生によって活性化される[16]。PAのTREK-1からの解離定数は約10 μMである[17]。こうした比較的弱い結合と膜中でのPA濃度の低さのため、チャネルは通常はオフ状態となっている。活性化に際して局所的に高濃度となることは、局所的な脂質拡散に少なくとも何らかの制限がかかっていることを示唆している。全体的に低濃度で維持され、局所的に強力な発火が生じるという性質は、PIP2シグナルとは対照的である。PIP2は膜中で比較的高濃度に維持され、タンパク質近傍で一過的に加水分解されることでPIP2シグナルが一過的に低下する[18]。標的タンパク質に強力な局所的影響を及ぼすためにシグナル伝達脂質の全体的濃度を変化させる必要がないという点では、PAシグナルとPIP2シグナルは類似している。
多くのシグナル伝達経路にPLDの活性化が関係していることや、コリン部分が存在しないことは、PAがシグナル伝達における重要性を示唆している。しかしながら、PAは迅速にDAGへ変換され、DAGもシグナル伝達分子として知られているため、PAはシグナル伝達に直接関与しているのか、それとも単にDAG産生の前駆体として機能しているのか、という疑問が生じる[19][20]。さらに、PAがDAGの前駆体としてのみ機能しているのならば、一段階でDAGを産生することができるPLCを持っている細胞がなぜ2つの酵素を利用するのか、という疑問も生じる。
PAとDAGは相互変換可能であるが、両者は同じ経路で作用するものではない。PLDを活性化する刺激はDAGの下流の酵素を活性化することはなく、逆もまた同様である。一例として、[γ-32P]ATP存在下での膜へのPLDの添加は[32P]標識PAと[32P]標識ホスホイノシチドの産生を引き起こすことが示されている[21]。DAGK由来のPAのリン酸基はキナーゼ活性によって新たに付加されたものであるため[32P]標識PAとなるが、PLD由来のPAのリン酸基はPCに由来するため標識されない[22]。DAGK阻害剤の添加によってDAGからPAへの変換を阻害することで[32P]標識PAの産生は消失するが、ホスホイノシチドの産生には影響しない[21]。
また、PAとDAGはシグナル伝達に関して異なるプールを維持している可能性がある。DAGシグナルは多価不飽和DAGによって媒介されている一方、PLD由来のPAは一過不飽和型もしくは飽和型であることが研究から示唆されている。そのため、機能的な飽和/一過不飽和PAは加水分解によって非機能的な飽和/一過不飽和DAGへと変換され、機能的な多価不飽和DAGは非機能的な多価不飽和PAへと変換されることとなる[19][23]。
このモデルは、PAとDAGのエフェクターは同じ頭部を持つがアシル鎖が異なる脂質を区別できるはずであることを示唆している。一部の脂質結合タンパク質は自身を膜内へ挿入し、アシル鎖の種類、もしくはその結果生じる膜の性質を認識している可能性があるが、多くの脂質結合タンパク質は細胞質基質に位置し、脂質の頭部のみとの結合によって膜に局在している。アシル鎖の差異はおそらく膜内での頭部の角度に影響を与えており、その場合にはPA結合タンパク質はPAを特異的に結合する必要があるだけでなく、頭部が正しい角度のものを特定できる必要があることを示唆している。その機構がどんなものであれ、こうした特異性を持つことは可能である。ブタ精巣のDAGKは多価不飽和DAG特異的であり[24]、ラット肝細胞の2種類のホスファチジン酸ホスファターゼはアシル鎖の異なるPAを異なる活性で脱リン酸化する[25]。他にもPSによるin vitroでのSK1活性の刺激は、ジオレオイル(C18:1)型、ジステアロイル(C18:0)型、1-ステアロイル,2-オレオイル型のPSによって大きく異なることが示されている[26]。
PA産生の測定[編集]
PAは迅速にDAGへ変換されるため、細胞内での寿命は極めて短い。このことはPA産生の測定が困難であり、そのため細胞内でのPAの役割の研究も困難であることを意味している。しかしながら、細胞へ第一級アルコールを添加することでPLD活性を測定することができる[27]。この場合PLDは加水分解ではなくホスファチジル基転移反応を行い、PAではなくホスファチジルアルコールを産生する。ホスファチジルアルコールは代謝の最終産物であり、容易に抽出と測定を行うことができる。このようにしてPLD活性やPA産生(PA自体ではないものの)の測定を行うことができ、またPA形成を遮断することで細胞過程へのPAの関与を推測することができる。
タンパク質との相互作用[編集]
出典[編集]
- ^ Welti, R; Li, W; Li, M; Sang, Y; Biesiada, H; Zhou, HE; Rajashekar, CB; Williams, TD et al. (30 August 2002). “Profiling membrane lipids in plant stress responses. Role of phospholipase D alpha in freezing-induced lipid changes in Arabidopsis.”. The Journal of Biological Chemistry 277 (35): 31994–2002. doi:10.1074/jbc.M205375200. PMID 12077151.
- ^ William W. Christie. “Phosphatidic Acid, Lysophosphatidic Acid and Related Lipids”. 2004年10月23日時点のオリジナルよりアーカイブ。2009年11月5日閲覧。
- ^ Schroeder, R.; London, E.; Brown, D. (December 1994). “Interactions between saturated acyl chains confer detergent resistance on lipids and glycosylphosphatidylinositol (GPI)-anchored proteins: GPI-anchored proteins in liposomes and cells show similar behavior”. Proceedings of the National Academy of Sciences of the United States of America 91 (25): 12130–12134. Bibcode: 1994PNAS...9112130S. doi:10.1073/pnas.91.25.12130. PMC 45390. PMID 7991596.
- ^ “Phospholipase D: molecular and cell biology of a novel gene family”. Biochem. J. 345 (3): 401–15. (February 2000). doi:10.1042/0264-6021:3450401. PMC 1220771. PMID 10642495.
- ^ Devlin, T. M. 2004. Bioquímica, 4ª edición. Reverté, Barcelona. ISBN 84-291-7208-4
- ^ Delon C; Manifava M; Wood E et al. (October 2004). “Sphingosine kinase 1 is an intracellular effector of phosphatidic acid”. J. Biol. Chem. 279 (43): 44763–74. doi:10.1074/jbc.M405771200. PMID 15310762.
- ^ P, Raghu (August 2012). “Lipid signaling in Drosophila photoreceptors”. Biochim Biophys Acta 1821 (8): 1154–1165. doi:10.1016/j.bbalip.2012.03.008. PMID 22487656.
- ^ Robinson, CV; Rohacs, T; Hansen, SB (September 2019). “Tools for Understanding Nanoscale Lipid Regulation of Ion Channels.”. Trends in Biochemical Sciences 44 (9): 795–806. doi:10.1016/j.tibs.2019.04.001. PMC 6729126. PMID 31060927.
- ^ a b c “Phosphatidic acid, a key intermediate in lipid metabolism”. Eur. J. Biochem. 266 (1): 1–16. (November 1999). doi:10.1046/j.1432-1327.1999.00822.x. PMID 10542045.
- ^ “Phosphatidate phosphohydrolase and signal transduction”. Chem. Phys. Lipids 80 (1–2): 45–57. (May 1996). doi:10.1016/0009-3084(96)02545-5. PMID 8681429.
- ^ a b Weigert R; Silletta MG; Spanò S et al. (November 1999). “CtBP/BARS induces fission of Golgi membranes by acylating lysophosphatidic acid”. Nature 402 (6760): 429–33. Bibcode: 1999Natur.402..429W. doi:10.1038/46587. PMID 10586885.
- ^ a b Blackwood RA; Smolen JE; Transue A et al. (April 1997). “Phospholipase D activity facilitates Ca2+-induced aggregation and fusion of complex liposomes”. Am. J. Physiol. 272 (4 Pt 1): C1279–85. doi:10.1152/ajpcell.1997.272.4.C1279. PMID 9142853.
- ^ “Prefission Constriction of Golgi Tubular Carriers Driven by Local Lipid Metabolism: A Theoretical Model”. Biophys. J. 85 (6): 3813–27. (December 2003). Bibcode: 2003BpJ....85.3813S. doi:10.1016/S0006-3495(03)74796-1. PMC 1303683. PMID 14645071. オリジナルの2008-05-07時点におけるアーカイブ。.
- ^ a b “Modulation of membrane curvature by phosphatidic acid and lysophosphatidic acid”. Traffic 4 (3): 162–74. (March 2003). doi:10.1034/j.1600-0854.2003.00086.x. PMID 12656989.
- ^ Robinson, CV; Rohacs, T; Hansen, SB (September 2019). “Tools for Understanding Nanoscale Lipid Regulation of Ion Channels.”. Trends in Biochemical Sciences 44 (9): 795–806. doi:10.1016/j.tibs.2019.04.001. PMC 6729126. PMID 31060927.
- ^ Comoglio, Y; Levitz, J; Kienzler, MA; Lesage, F; Isacoff, EY; Sandoz, G (16 September 2014). “Phospholipase D2 specifically regulates TREK potassium channels via direct interaction and local production of phosphatidic acid.”. Proceedings of the National Academy of Sciences of the United States of America 111 (37): 13547–52. Bibcode: 2014PNAS..11113547C. doi:10.1073/pnas.1407160111. PMC 4169921. PMID 25197053.
- ^ Cabanos, C; Wang, M; Han, X; Hansen, SB (8 August 2017). “A Soluble Fluorescent Binding Assay Reveals PIP2 Antagonism of TREK-1 Channels.”. Cell Reports 20 (6): 1287–1294. doi:10.1016/j.celrep.2017.07.034. PMC 5586213. PMID 28793254.
- ^ Pavel, MA; Chung, HW; Petersen, EN; Hansen, SB (October 2019). “Polymodal Mechanism for TWIK-Related K+ Channel Inhibition by Local Anesthetic.”. Anesthesia and Analgesia 129 (4): 973–982. doi:10.1213/ANE.0000000000004216. PMID 31124840.
- ^ a b “Diacylglycerols and phosphatidates: which molecular species are intracellular messengers?”. Trends Biochem. Sci. 23 (6): 200–4. (June 1998). doi:10.1016/S0968-0004(98)01200-6. PMID 9644971.
- ^ Wakelam MJ (December 1998). “Diacylglycerol--when is it an intracellular messenger?”. Biochim. Biophys. Acta 1436 (1–2): 117–26. doi:10.1016/S0005-2760(98)00123-4. PMID 9838074.
- ^ a b “Phosphatidic acid is a specific activator of phosphatidylinositol-4-phosphate kinase”. J. Biol. Chem. 267 (11): 7207–10. (April 1992). doi:10.1016/S0021-9258(18)42504-5. PMID 1313792.
- ^ “The Ca2+-activated polyphosphoinositide phosphodiesterase of human and rabbit neutrophil membranes”. Biochem. J. 221 (2): 477–82. (July 1984). doi:10.1042/bj2210477. PMC 1144062. PMID 6089740.
- ^ “Phosphatidate accumulation in hormone-treated hepatocytes via a phospholipase D mechanism”. J. Biol. Chem. 262 (31): 15309–15. (November 1987). doi:10.1016/S0021-9258(18)48176-8. PMID 3117799.
- ^ “Purification and characterization of sn-1-stearoyl-2-arachidonoylglycerol kinase from pig testes”. Biochem. J. 322 (Pt 2): 529–34. (March 1997). doi:10.1042/bj3220529. PMC 1218222. PMID 9065773.
- ^ “Purification and characterization of N-ethylmaleimide-insensitive phosphatidic acid phosphohydrolase (PAP2) from rat liver”. Biochem. J. 308 (Pt 3): 983–9. (June 1995). doi:10.1042/bj3080983. PMC 1136819. PMID 8948459.
- ^ “Effect of acidic phospholipids on sphingosine kinase”. J. Cell. Biochem. 60 (4): 529–37. (March 1996). doi:10.1002/(SICI)1097-4644(19960315)60:4<529::AID-JCB9>3.0.CO;2-U. PMID 8707892.
- ^ “Measurement of phospholipase D activity”. Anal. Biochem. 252 (1): 1–9. (October 1997). doi:10.1006/abio.1997.2299. PMID 9324933.
- ^ Wiczer, Brian M; Thomas, George (27 Mar 2012). “Phospholipase D and mTORC1: Nutrients Are What Bring Them Together”. Sci. Signal. 5 (217): pe13. doi:10.1126/scisignal.2003019. PMID 22457329.
- ^ Cabanos, C; Wang, M; Han, X; Hansen, SB (8 August 2017). “A Soluble Fluorescent Binding Assay Reveals PIP2 Antagonism of TREK-1 Channels.”. Cell Reports 20 (6): 1287–1294. doi:10.1016/j.celrep.2017.07.034. PMC 5586213. PMID 28793254.
- ^ Hite, RK; Butterwick, JA; MacKinnon, R (6 October 2014). “Phosphatidic acid modulation of Kv channel voltage sensor function.”. eLife 3. doi:10.7554/eLife.04366. PMC 4212207. PMID 25285449.
- ^ Hansen, SB; Tao, X; MacKinnon, R (28 August 2011). “Structural basis of PIP2 activation of the classical inward rectifier K+ channel Kir2.2.”. Nature 477 (7365): 495–8. Bibcode: 2011Natur.477..495H. doi:10.1038/nature10370. PMC 3324908. PMID 21874019.
